Tháng 10/2016, trên tạp chí Nature, Rodina và cộng sự [1] đã công bố phát hiện bất ngờ về một phức hợp phân tử xuất hiện trong tế bào ung thư có liên quan tới protein sốc nhiệt (heat-shock proteins – HSPs). HSPs là họ protein được tạo ra bởi tế bào khi chúng tiếp xúc với các điều kiện căng thẳng (stressful conditions) như nóng, lạnh, tia cực tím hay thiếu hụt oxy… [2]. Các nhà khoa học đã tìm thấy trong nhiều loại tế bào ung thư đều có một lượng đáng kể phức hợp phân tử lớn có tên gọi epichaperome. Đây là một phức hợp giữa HSP90 và các protein khác. Phức hợp này chỉ tồn tại trong các tế bào ung thư mà không có trong tế bào thường. Phát hiện này đã mở ra một hướng mới trong chiến lược thiết kế thuốc điều trị ung thư hướng đích cũng như chế tạo sinh phẩm chẩn đoán và phát hiện sớm bệnh ung thư.
HSPs tồn tại phổ biến trong tế bào động vật có vú, được đặt tên theo khối lượng phân tử của chúng (ví dụ: HSP35, HSP60, HSP90...). Ở điều kiện bình thường, HSPs hoạt động như một chaperone nhằm đảm bảo cấu trúc không gian cho các protein của tế bào để thực hiện đúng chức năng và vai trò của chúng. Tuy nhiên, Rodina và cộng sự đã phát hiện ra sự khác biệt về mặt cấu trúc cũng như vai trò của HSPs trong các tế bào ung thư so với tế bào thường. Với một số loại tế bào ung thư, các protein này tồn tại ở dạng phức hợp lớn chứ không riêng lẻ như ở trong tế bào bình thường [3].
Đặc tính của HSPs được nghiên cứu bằng cách tách phức hợp này ra khỏi các protein tế bào. Thử nghiệm trên rất nhiều dòng tế bào khác nhau, các nhà khoa học đã phân loại tế bào ra thành 2 týp: “týp 2” là nhóm các tế bào có HSP90 (chaperome phổ biến nhất trong tế bào) được phân tách một cách rõ ràng theo đúng dạng cấu trúc của nó. Nhóm này bao gồm một số dòng tế bào thường và tế bào ung thư; còn “týp 1” là nhóm tế bào có HSP 90 liên kết thành các phức hợp protein lớn, được gọi là epichaperome, nhóm này chỉ gồm các loại tế bào ung thư. Hoạt tính của HSP90 đã được khảo sát bằng chất ức chế chức năng protein (PU-H71), kết quả cho thấy HSP90 liên kết chặt chẽ với PU-H71 khi chúng tồn tại dưới dạng epichaperome (các tế bào týp 1). Do vậy, số lượng tế bào trong nhóm “týp 1” sẽ bị chết nhiều hơn so với lượng tế bào nhóm“týp 2” (Hình 1).

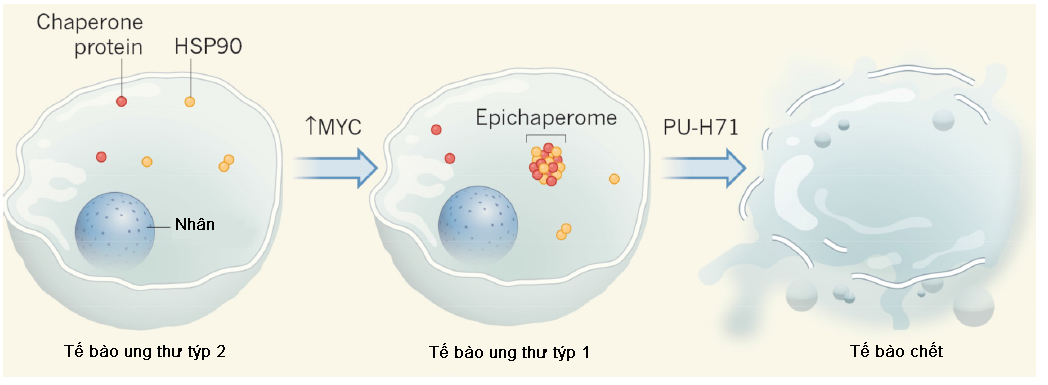
Hình 1. Epichaperome trong tế bào ung thư và cơ chế hoạt động diệt tế bào [1].
Trong các tế bào ung thư týp 2, chaperone protein tồn tại riêng lẻ dưới dạng các phức hợp nhỏ. Tuy nhiên, trong tế bào ung thư týp 1, các chaperone liên kết với nhau và với các protein khác hình thành phức hợp epichaperome. Khi tăng cường biểu hiện gen điều hòa MYC, sự xuất hiện của epichaperome đã tăng lên trên nhóm tế bào ung thư“týp 2”. Tế bào chứa epichaperome sẽ bị tiêu diệt khi sử dụng PU-H71 (chất ức chế hoạt động của epichaperome).
Tuy nhiên, nghiên cứu cũng đã chỉ ra rằng, sự khác nhau ở trên cơ bản không chỉ phụ thuộc vào sự ức chế sinh hóa gây ra bởi PU-H71 mà còn do có sự tồn tại của các epichaperome. Điều đáng chú ý là epichaperome không phụ thuộc vào sự đặc hiệu của bất kỳ tế bào ung thư chuyên biệt nào, mà bị điều phối bởi hoạt động liên quan đến biển hiện gen điều hòa MYC. Khảo sát bằng phương pháp tách protein sử dụng các kỹ thuật sinh hóa đã cho thấy epichaperome xuất hiện trên nhiều loại tế bào ung thư khác nhau như: ung thư vú, ung thư bạch cầu, ung thư tuyến tụy và một số loại ung thư khác với tỷ lệ 60-70%[1,4].
Kết quả nghiên cứu của Rodina và cộng sự thông qua việc phát hiện epichaperome và vai trò của nó trong tế bào ung thư đã đưa ra cách tiếp cận mới trong chẩn đoán và điều trị ung thư hướng đích, mở ra tiềm năng to lớn trong chiến lược phát triển các chất ức chế đặc hiệu cho phức hợp epichaperome, đồng thời tạo động lực cho sự phát triển thuốc đặc trị cũng như kỹ thuật chẩn đoán sớm ung thư.
Tài liệu tham khảo 1. Rodina A, Wang T, Yan P, Gomes ED, Dunphy MPS, Pillarsetty N, et al. The epichaperome is an integrated chaperome network that facilitates tumour survival. Nature2016; 538: 397–401.
2. Finka A, Goloubinoff P. Proteomic data from human cell cultures refine mechanisms of chaperone-mediated protein homeostasis. Cell Stress Chaperones. Netherlands; 2013;18(5):591–605.
3. Brehme M, Voisine C, Rolland T, Wachi S, Soper JH, Zhu Y, et al. A chaperome subnetwork safeguards proteostasis in aging and neurodegenerative disease. Cell Rep. United States; 2014;9(3):1135–50.
4. Bartkowiak K, Pantel K. Cancer: A shocking protein complex. Nature. 2016; Available from: http://www.nature.com/doifinder/10.1038/nature19476
CN. Phạm Thị Minh Huyền
Trường Đại học khoa học tự nhiên, Đại học Quốc gia Hà Nội
TS. Trần Quang Huy
Viện Vệ sinh Dịch tễ Trung ương
